Атом Бора. Плодотворная теория
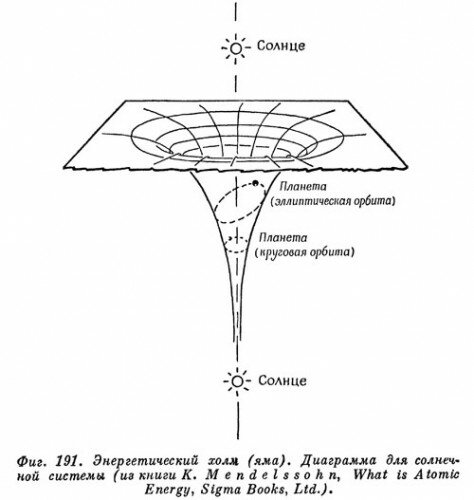
Бор сохранил резерфордовскую картину атома, в котором электроны мчатся по орбитам вокруг ядра, притягивающего их с силой, обратно пропорциональной квадрату расстояния. Поэтому «диаграмму холма» для их энергии (диаграмму потенциальной энергии) нужно было бы изображать по-прежнему. Как и в случае настоящей солнечной системы, эта диаграмма для сил притяжения изображает яму вместо холма. Но второе правило квантовых ограничений Бора как бы вырезает уступы вдоль стен ямы и ограничивает орбиты этими уступами. На фиг. 191 показан набросок «диаграммы холма» для Солнца, вокруг которого по круговой орбите движется одна планета, а другая описывает эллипс.
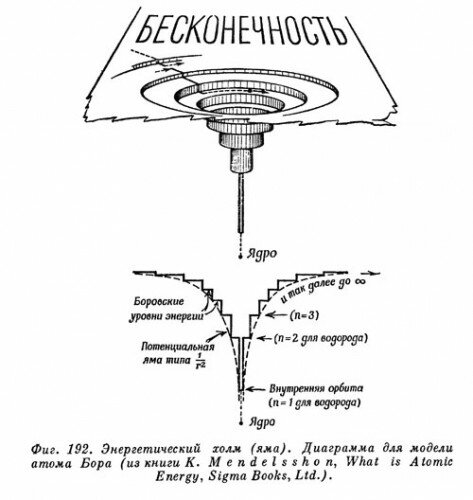
Этот «холм» был хорош для сил притяжения к Солнцу. Аналогичной была бы «диаграмма холма» для ядра и электронов в «атоме Резерфорда без квантовых ограничений». На фиг. 192 показана упрощенная «диаграмма холма» атома с набором «квантовых уступов» для круговых орбит. В схеме Бора были учтены также другие уступы (уровни энергии), отвечающие эллиптическим орбитам. Форма, размеры и другие характеристики каждой орбиты были определены несколькими квантовыми числами.
Низший уступ, определенный по квантовым правилам Бора значением n=1, дает наименьшую разрешенную орбиту. Здесь энергия электрона минимальна; эта орбита наиболее стабильна, поэтому можно было бы ожидать, что электрон будет падать вниз до этого уровня, если только это возможно, и останется здесь. Действительно, следовало бы спросить: почему же не все электроны падают на этот нижний уступ, а все атомы не сжимаются до минимальных размеров? Мы знаем, что так не происходит, и это была одна из многих тайн, которые вскоре объяснились правилом, сформулированным В. Паули под названием принципа исключения х). Здесь принцип в сущности утверждает, что на уступе может находиться лишь один электрон, только один электрон с данным набором квантовых чисел. Никогда, ни в каком атоме несколько электронов не могут занимать совершенно одинаковые орбиты. Теперь, правда, мы удваиваем каждый выступ, чтобы поместить туда два электрона с противоположными спинами. С помощью современных знаний можно обосновать принцип Паули, однако долгое время он оставался произвольным, но очень полезным руководством для моделей атома.
В сущности Бор сказал: «Электроны не могут непрерывно излучать; атомы не подчиняются традиционным законам физики. Если вы примете мое смелое предположение, факты обретут больше смысла». А Паули добавил ограничительное правило: «Только один электрон на орбите». Эти правила выглядят как законодательство, основанное на декретах, но они успокаивают волнение, вызванное парадоксами атомной модели, обогащая знания. Они дали Бору возможность вычислить универсальную постоянную спектра, исходя из фундаментальных компонент е, h, с, е/m, и плодотворно объяснили все спектры, которые вскоре после объяснения перешли в разряд решенных проблем, и осветили другие нерешенные проблемы. Еще когда Бор продолжал развивать свои правила, Мозли использовал их в грубой теории спектров рентгеновских лучей, что позволило ему измерить атомные номера,— почти перед этим стал понятен смысл атомного номера с точки зрения строения атома, содержащего ядро.
Правила Бора, например, предсказывают диаметр обычного атома водорода, который уже был экспериментально известен из грубых измерений.
Автор Эрик Роджерс “Физика для любознательных”
Технические игрушки
ДРУГИЕ НАШИ ПРОЕКТЫ
Интересные игрушки
Поделки дома
А Вам слабо?
Своими руками с детьми
От дачи до дома
Что готовите?